技术交流
510(k)技术文件清单
发布时间:2023-12-13 07:55:19 浏览量:409
如果想要在美国上市I或II类器械,除非该器械获得《联邦食品、药品和化妆品法案》的豁免,否则必须在上市前90天内向FDA提交510(k),上市前提交需满足21 CFR 807 E部分规定的要求,一起来看下一份传统的510(k)技术文件清单吧。
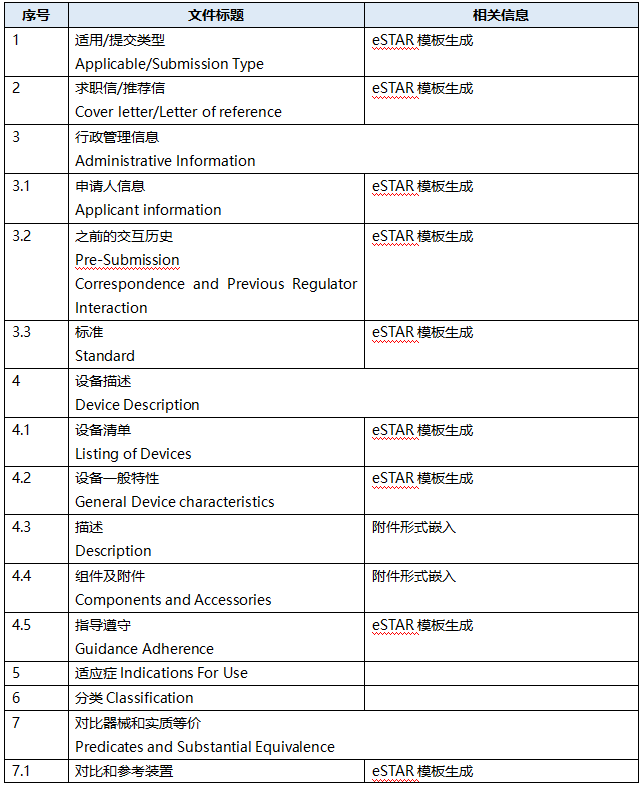
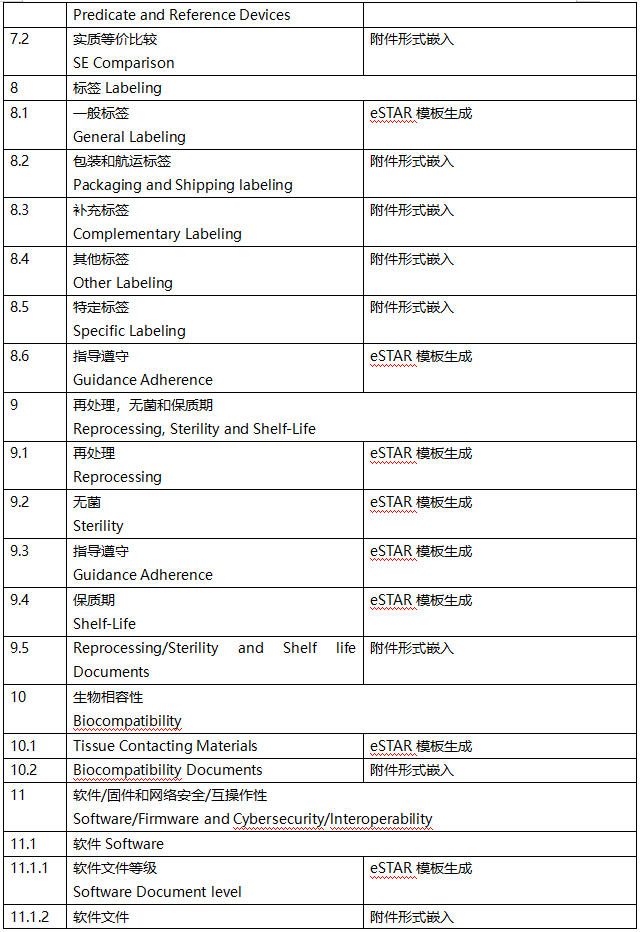
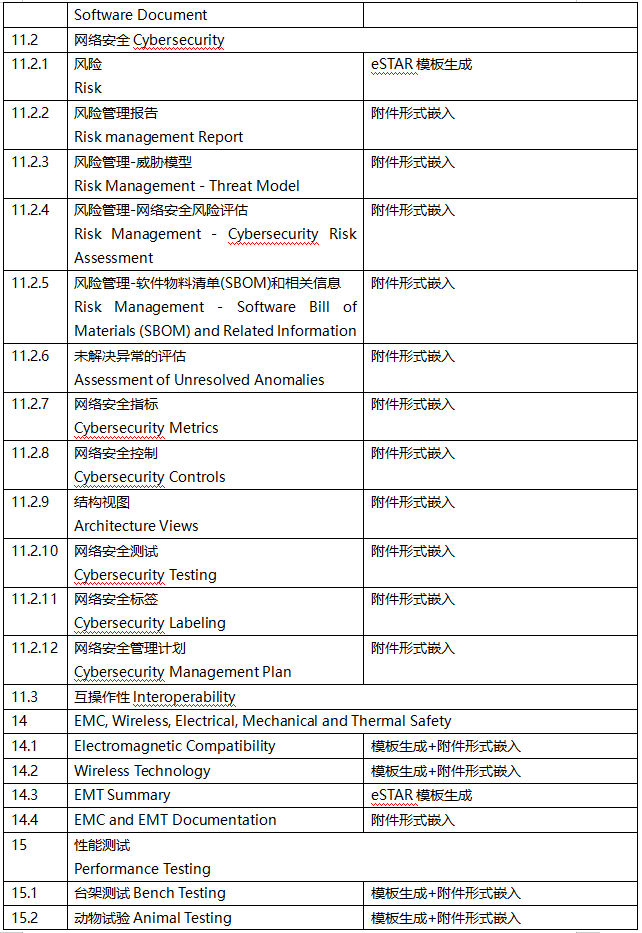
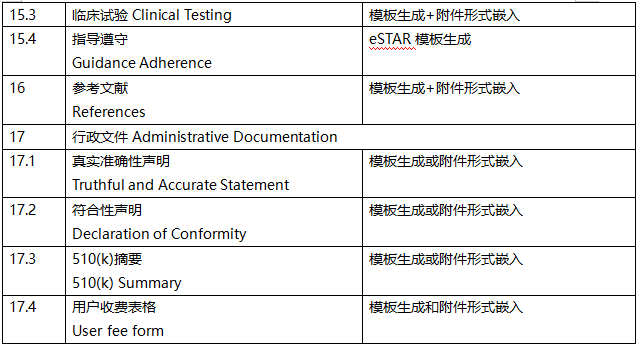
eSTAR下载链接如下:
https://www.fda.gov/medical-devices/how-study-and-market-your-device/estar-program
上一个:没有了
下一个:中美欧UDI核心内容汇总
导航栏目
联系我们
彭老师
电话:13127819095
微 信 号/QQ:283277725
邮箱:alin.peng@linnwell.com
陈老师
电话/微信号:15021397762
邮箱:yuling.chen@linnwell.com
羚证医药技术服务(上海)有限公司
Linnwell International Certification Consulting Co., Ltd.
地址:上海市闵行区万芳路333号(上海国家民用航天产业基地)一号楼辅楼一楼
网址:www. linnwell.com
Linnwell International Certification Consulting Co., Ltd.
地址:上海市闵行区万芳路333号(上海国家民用航天产业基地)一号楼辅楼一楼
网址:www. linnwell.com