新闻中心
FDA 510k 新的递交方式 eSTAR
摘要
为了支持仅以电子格式递交510(k)文件,FDA开发了一种交互式的PDF表格Electronic Submission Template And Resource,简称eSTAR。该模板通过标准化的格式,由一系列问题、文本、逻辑和提示组成,指导用户以电子格式提交510(k)申请。eSTAR可以确保上市前提交的完整性和一致性,并帮助FDA更有效地进行上市前审查。
eSTRA发展脉络
2018年9月,FDA启动了510(k)质量审查计划试点
2020年2月,CDRH启动eSTAR试点计划,开发并试点使用了电子提交模板和资源
2021年9月,FDA发布草本指南Electronic Submission Template for Medical Device 510(k) Submissions
2022年6月,CBER开始试用eSTAR
2022年9月22日,FDA发布了最终指南Electronic Submission Template for Medical Device 510(k) Submissions
2023年6月9日,FDA更新用于预提交内容的eSTAR模板
时间安排
2023年10月1日之前,eSTAR属于自愿性质的计划,申请者可以选择通过eCopy或eSTAR格式递交510(k) 文件。
2023年10月1日之后,FDA仅接受以eSTAR格式递交510(k) 文件,除非获得豁免。
适用范围
l 向器械和放射健康中心(CDRH)提交的510(k)申请,De Novo请求,Pre-Submissions申请;
l 向生物制剂评估和研究中心(CBER)提交的510(k),申请人自愿使用;
l 组合产品
审核时间表
由于eSTAR具有自动验证功能,因此FDA不打算对eSTAR提交的申请进行拒绝接受(RTA)审查,RTA审查时间为15个日历日。但是FDA会对eSTAR提交实行病毒扫描和技术筛选过程,该过程的所需时间为15个日历日。
如果eSTAR提交时不完整,FDA将通过电子邮件通知提交者并识别不完整的信息,提交将被搁置180天或直到提交者向FDA提交完整的替代eSTAR。
如何下载eSTAR模板
Windows: 在浏览器中,右键单击链接并选择“链接另存为”;
Mac OS: 在 Safari浏览器中,按“控制”+ 单击链接并选择“下载链接文件”;
当前eSTAR版本
|
eSTAR PDF模板 |
此eSTAR模板可用于提交给CDRH |
|
非体外诊断eSTAR版本4 |
非体外诊断设备的510(k)和De Novo |
|
非体外诊断eSTAR版本3(将于2023-08-13退役) |
非体外诊断设备的510(k)和De Novo |
|
体外诊断eSTAR版本4 |
体外诊断设备的510(k)和De Novo |
|
体外诊断eSTAR版本3(将于2023-08-13退役) |
体外诊断设备的510(k)和De Novo |
|
早期提交请求eSTAR(PreSTAR)测试版 |
体外诊断和非体外诊断设备的预提交(一种Q-Submission类型) |
温馨提示:如需跳转原文,请点击链接。
eSTAR优点:
自动化(例如,表单构建,自动填充);
与FDA内部审核模板互补的内容和结构;
整合多种资源(如指南、数据库);
每个提交部分的指导;
自动验证;
免费使用;
使用熟悉的软件应用程序,Adobe Acrobat Pro;
更多动态功能,例如支持带有超链接的图像和消息;
支持制定补充条款和某些修正案;
移动设备对某些动态PDF功能的兼容性;
在动态版本扁平化后,提交者可以在PDF中添加评论,以帮助提交准备;
eSTAR使用技巧:
eSTAR模板包含了结构化数据(模板中下拉框、复选框等中的数据和内容),和非结构化数据(作为附件提交的数据和内容)。类似内容的附件建议合并,以便每个附件类型只需要提供一个附件,合并的文档最好包含书签或目录,以便于FDA查看。
附件最好不超过1 GB,eSTAR总容量不超过4 GB。
确保附加的图像和视频都压缩为可在Windows操作系统或VLC Media Player应用程序(例如JPEG,AVC MP4,HEVC MP4)中查看的Microsoft兼容格式。建议对视频使用 HEVC 视频压缩。仅当需要高分辨率来支持设备审查时,才应提供超高清视频。
红色条表示相关的必答问题或该部分中的必答问题未被回答;
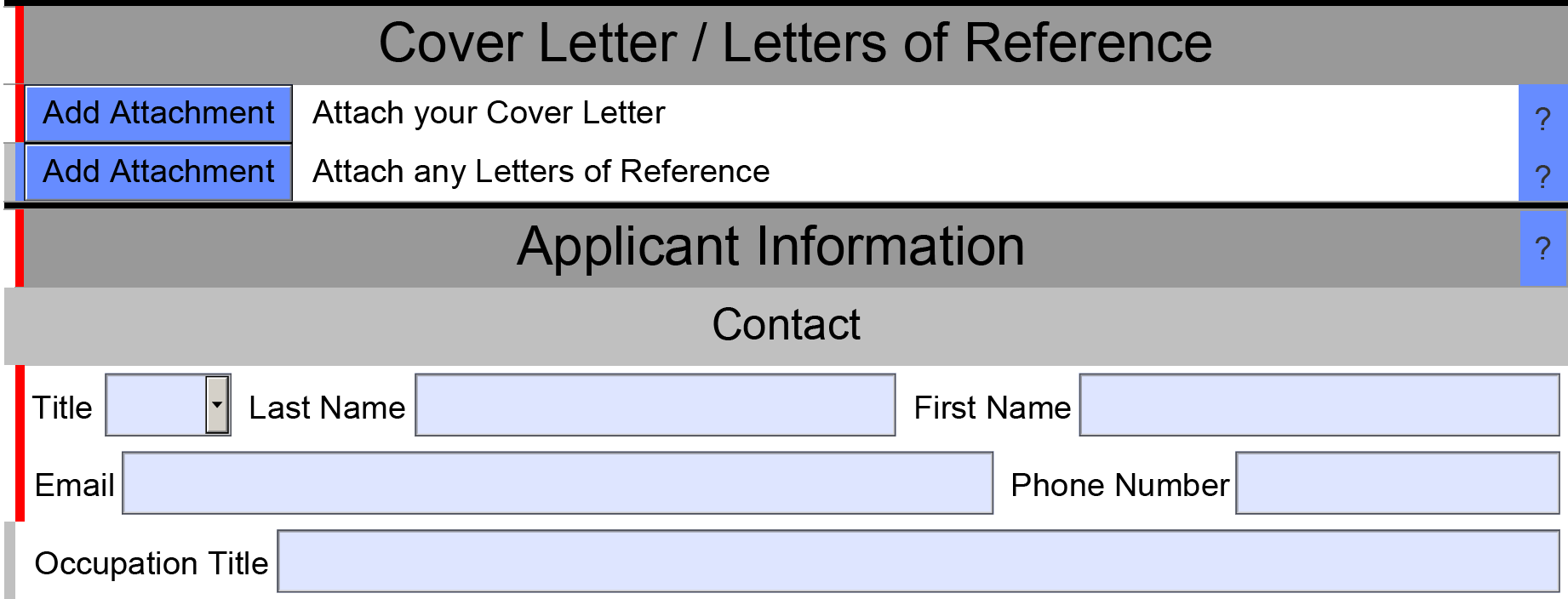
绿色条表示已回答相关的必答问题或该部分中的所有必答问题;

灰色条表示关联的问题是可选的;
eSTAR完成时,应使绿色条和灰色条出现在左边框;
单击?
文本上悬停可显示有关您的应用程序的信息,例如附件的附加日期,或者,如果该节对应d的IMDRF协调章节号。
如何提交eSTAR
提交给CDRH时使用FDA的电子门户网站CDRH Portal,任何人均可通过注册CDRH Portal的账号在线提交eCopy或eSTAR;
提交给CBER时通过FDA的电子提交网关ESG提交。
导航栏目
联系我们
彭老师
电话:13127819095
微 信 号/QQ:283277725
邮箱:alin.peng@linnwell.com
陈老师
电话/微信号:15021397762
邮箱:yuling.chen@linnwell.com
Linnwell International Certification Consulting Co., Ltd.
地址:上海市闵行区万芳路333号(上海国家民用航天产业基地)一号楼辅楼一楼
网址:www. linnwell.com